药物递送系统的演变:1950至2020年及未来发展
前言
现代药物递送技术始于1952年Spansule®缓释胶囊,该技术通过口服速释伴随着12小时的缓释实现了可控的口服给药。到80年代,口服和透皮给药提供了可达24小时的治疗效果并且主导了药物递送领域的市场。1989年,Lurpo Depot®的推出为长效注射剂和植入剂打开了大门,将药物递送的时间从几天延长到几个月,甚至几年。与此同时值得注意的是,同样有新技术实现了肽和蛋白质药物的注射长效给药。1990年第一个PEG(聚乙二醇)化的蛋白制剂Adagen®标志PEG化时代的开始。1995年出现了Doxil®(阿霉素PEG化脂质体),2014年出现了Movantik®(PEG化纳洛酮-naloxgel),以及2018年的Onpattro®(Patisiran-PEG化脂质纳米粒载siRNA)。药物-聚合物复合物,例如1974年推出的InFed®(铁-葡聚糖复合物注射液)和2005年的Abraxane®(紫杉醇-白蛋白复合物)。2000年出现了Mylotarg™(gemtuzumab ozogamicin抗体药物偶联物)和Rapamune®(西罗莫司纳米晶制剂)。同年,美国政府发起了国家纳米技术计划,世界其他国家也纷纷效仿。纳米制剂开始被广泛研究,特别是设计用于被肿瘤细胞摄取后可从胞内体逃逸的制剂,以及PEG化的技术,最终成就了脂质纳米粒的开发和2020年新冠疫苗的产生。虽然过去七十年来药物递送系统的进步令人叹为观止,但是它们只是尚未批准的处方甚至是尚未完全开发出的技术中的冰山一角。随着人类预期寿命的不断增加,越来越多的人需要对各种疾病进行长期护理。满足当前和未来并未满足的治疗需求需要新的技术突破和解决老问题,例如如何提高难溶药物的水溶性、克服生物障碍、开发更有效的长效制剂。从过去汲取的经验教训是开发新产品的宝贵经验财富。正如新冠疫苗开发所表明的那样,应对不确定的未来和不可预见的危机需要不断积累失败经验、知识和技术。有意识地整合多元化的学科知识和技能成为了比以往更重要的任务。
药物递送系统的演变
“药物递送系统”一词囊括了包括片剂、胶囊、溶液剂在内的处方制剂。区别于传统快速、不可控的药物释放模式,“缓控释制剂”代表了一系列可以控制药物释放的制剂技术。缓控释制剂具有随着时间保证在血液中含量相对恒定的药物浓度的附加含义。然而,保持恒定的血浆药物浓度是困难的,特别是对于口服控释制剂。图一描述了FDA批准情况而展现出的药物递送系统发展情况。从图中可以看出,最开始的发展集中于口服和透皮给药,主要机理围绕着扩散、溶出、渗透、离子交换。在这之中,溶出和扩散为主导的药物递送机理为最广泛研究。
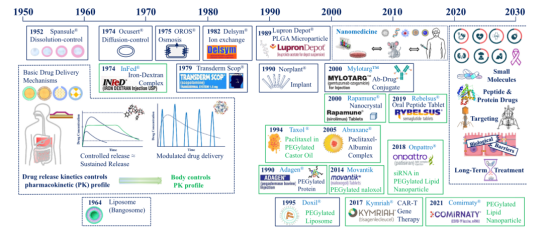
图一:通过引入FDA批准的药物产品可见的药物递送系统的演变,从Spanule®口服控释制剂到新冠脂质纳米粒制剂。
只要血液中的药物浓度保持在最大安全浓度以下和最小有效浓度以上,提供更长释放时间的制剂在理论上与速释制剂一样有效。最大安全浓度和最小有效浓度的比值也称为治疗指数。由于大多数药物的治疗指数都足够大,即使过量服用药物也是安全的,因此血液中的药物浓度的波动并不会改变疗效。控释给药系统可以最大程度地减少血浆浓度峰谷值的大小,从而最大程度减少潜在的副作用和药物无效期。由于血液中的药物浓度不一定要保持恒定才能安全有效,因此开发了各种“延长”和“缓释”制剂。尽管如此它们最后都被归纳为“缓控释制剂”——即以零或一级速率常数释放的制剂。根据FDA规定,缓释固体口服剂型是指缓释、迟释或肠溶制剂。如今几乎所有的制剂都是为持续给药而制造的,因此,“给药系统”用于代表所有类型的制剂。传统的片剂和胶囊被称为速释制剂。自1980年后,缓释也意味着几个月的药物递送。因此,需要在药物递送技术和特定的背景下理解缓控释的含义。
起点
Spansule®等给药技术
Spansule®技术最开始应用于递送硫酸右旋苯丙胺,随后是盐酸苯丙醇胺+马来酸氯苯那敏。该技术通过制备包衣屏障来控制制剂内部的溶出度,从而起到控制药物溶出。同时,该技术也促进了利用其他不同释放机制的口服制剂的开发,例如利用扩散机制的Ocusert®(毛果芸香碱)、渗透压控制(口服渗透技术,OROS®)、离子交换控制的右美沙芬Delsym®。其中,溶出和扩散控制的产品在FDA批准的制剂数量中占主导地位。基于渗透的产品大约有20种,而基于离子交换机制的产品只有一种。由于离子交换机制不适合在高盐环境中持续释放,树脂颗粒也涂有限制扩散的聚合物。扩散控制机制在透皮制剂中也有广泛应用。在1950年到1980年也开发了很多其他控释机制,但是大多数产品都是基于溶解和扩散机制或者为两者的混合。Norplant是一种火柴棍大小的圆柱形制剂,内含一种避孕药物,可缓慢释放五年。它在1990年于FDA获批,比其他利用储层技术的其他制剂晚的多,仅仅因为它需要更长的临床试验期。尽管如此,它在2002年退市,主要是由于插入和移除体内的难度以及缺乏对植入制剂的管理经验。在最初的30年中,药物释放的数学模型得到了发展,这些成果使得药物递送迈向成熟。
零级和可调控药物释放
药物以零级速率释放的能力吸引了许多科学家开发可以在血液中保持恒定药物浓度的口服制剂。尽管如此,由于一些生理限制,制作这种口服制剂很困难。首先,当口服制剂从胃转移到肠道时,由于肠道下段的吸收能力降低,药物吸收通常会降低。随着时间的推移,从制剂中释放的药物量减少,这通常会加剧这个问题。保持恒定血液浓度约 16 小时的唯一例子是苯丙醇胺HCl 从 Acutrim®(一种OROS 制剂)中释放。当制剂通过肠道时,补偿降低的药物吸收需要随着时间的推移释放更多的药物,这比制造零级释放制剂复杂得多。此外,无需在血液中保持恒定的药物浓度,因为大多数药物的治疗指数大到足以在不同血药浓度的数量级。除此之外,自我调节的递送系统对于胰岛素递送至关重要,因为随着血液中葡萄糖浓度的波动,需要在正确的时间和准确的量递送胰岛素。但迄今为止开发的受控技术仅限于以特定速率连续释放,而调制释放仍然遥不可及。例如,对于胰岛素递送,配方需要包含葡萄糖传感器和控制胰岛素释放的反馈系统。调制给药系统仍然是最复杂的技术问题。希望完全植入式调制递送系统能够尽快开发和商业化。
早期给药技术发展节点
一开始技术进步的关键点是控释制剂用于 12 或24 小时给药的口服制剂,在某种程度上,也适用于透皮制剂。对于口服制剂,体外药物释放曲线通常与体内药代动力学曲线(PK)相关。因此,可以通过控制配方参数来调整 PK 曲线。控释制剂开始提供更长的时间,从数周到数月不等。然而,体外药物释放动力学不再决定 PK 曲线。开发可提供 24 小时药物的处方与开发设计为 24 周的处方有很大不同。
1. 长效注射剂
1.1 基于PLGA的递送系统
美国食品和药物管理局 (FDA) 批准的第一个长效注射剂是Lupron Depot®,可提供 1 个月的醋酸亮丙瑞林释放。自1989 年首次获得批准以来,PLGA 微粒制剂通过调整丙交酯:乙交酯 (L:G) 比率和聚合物的分子量,已将药物递送时间延长至 6 个月。该技术也被用于递送各种小分子、肽和蛋白质。FDA 批准的所有基于聚合物的、可生物降解的长效注射制剂均基于 PLGA 聚合物,因为它们具有良好的安全应用历史。虽然其他生物可降解聚合物可能提供更好的功能,例如更好的控制药物释放和更高载药量的特性,但 FDA 批准的产品中没有任何用途需要额外的监管障碍,例如毒理学研究,以证明聚合物在注射或植入后的安全性。
控制数周和数月的药物释放动力学与一天的药物释放显着不同。长达 6 个月的长效制剂需要大剂量,并且需要在其整个治疗周期内控制药物释放。目前,三种不同的配方类型可以提供长达 6 个月的药物:微粒、原位形成植入物和固体植入物。微粒制剂最为常见,因为它们能够装载大量药物(高达总固体含量的 35%)、控制药物释放以及通过肌内或皮下注射给药。虽然已经使用 PLGA 聚合物开发了20余个产品,但令人惊讶的是,我们对PLGA 聚合物的了解很少。尽管 PLGA 制剂开发已经超过3 年,但目前市场上没有获得 FDA 批准的长效注射制剂仿制药产品。造成这种情况的原因之一是缺乏对 PLGA 聚合物的彻底表征。为了批准仿制药,FDA 需要考虑拟申请的产品在非活性成分方面是否与参考上市药物 (RLD) 的定性 (Q1) 和定量(Q2) 相同。要确定所使用的 PLGA 聚合物是否为相同组分(Q1) 和相同浓度 (Q2) 中的相同组分,必须分析它们的L:G 比、分子量和端基。当 RLD 使用一种以上的PLGA 类型或非常规 PLGA 聚合物时,问题变得复杂,例如,支化PLGA 而不是线性 PLGA。PLGA 的彻底表征将为通过使用最佳 PLGA 优化药物加载和释放提供了良好数据支持。
1.2 纳米混悬液
纳米晶混悬液是另一类长效注射剂,主要由疏水性药物和少量赋形剂或表面活性剂组成,其载药量非常高。高能研磨被广泛用作此类制剂的制备方法。此外,活性分子可以合成为前药,通常带有长链脂肪酸,以进一步降低水溶性和/或溶解速率。帕潘立酮棕榈酸酯 (Invega Sustenna®) 是帕潘立酮棕榈酸酯的纳米晶体悬浮液,是利培酮的活性代谢物。另一种固态制剂手段是将药物配制成具有疏水性抗衡离子/构象物的盐或共晶。奥氮平pamoate(Zyprexa Relprev®) 是奥氮平的纳米晶体盐制剂,双羟萘酸作为反离子。虽然这些制剂由于载药量非常高而具有优势,但可能出现的问题包括晶型的变化、混悬液内的聚集和组织刺激。
2. 聚乙二醇(PEG)化
2.1 PEG化蛋白质和脂质体制剂
PEG化是将PEG连接到蛋白质分子上的过程,这样蛋白质在血液中的循环时间比对照更长,免疫原性反应显着降低。然而,随后对 PEG 化蛋白和药物递送系统的研究表明,身体会产生针对PEG 的抗体,导致血液清除加速 (ABC)。因此,更有效地使用PEG 化需要更好的理解。已知亲水性 PEG 分子会在蛋白质表面摆动,以减少网状内皮细胞的摄取、蛋白水解降解和免疫反应,从而提高治疗效果。PEG化还通过减少与靶位点的结合来降低蛋白质药物的生物活性,但整体循环时间越长,治疗效果就越强。 PEG化的概念由罗格斯大学的Frank Davis 教授在 1970 年代后期提出。PEG化的主要优点是它增加了血液循环时间,这个想法被用来改善脂质体的保留时间。第一个成功的PEG化脂质体制剂是1995 年批准的 Doxil®,表明肿瘤吸收增加并降低毒性,特别是多柔比星的心脏毒性。1990 年,在第一个长效可注射 PLGA 制剂Lupron Depot® 获得批准后不久,第一个PEG化蛋白的注射剂制剂(Adagen®,pegademasebovine injection)获得批准。图一显示了FDA批准的PEG化蛋白药物的介绍。在过去的 30 年中,已经开发了大约20 种PEG化蛋白质制剂。PEG化干扰素-α2b 目前用于治疗新冠。
PEG化技术的意义不仅仅在于增加修饰蛋白的循环次数,及其应用从 1995 年的 Doxil®(PEG化脂质体递送阿霉素)开始到脂质体制剂,是其他重要制剂的开端。在 Alec Bangham 于1964 年首次观察到多层脂质结构后,脂质体最初被称为 Bangosomes 或近晶相。由于脂质结构是用磷脂配制而成的,所以后来更名为脂质体。脂质体作为药物递送系统的潜力首先由 Gregory Gregoriadis提出。后来,脂质体也被用来将 DNA 递送到细胞中。自从首次批准PEG化脂质体制剂 Doxil® 以来,已有十多种脂质制剂用于临床。除了脂质体,含有PEG化脂质的脂质纳米颗粒在递送寡核苷酸方面也取得了成功,例如 2018 年的 Onpattro®(PEG化脂质纳米颗粒中的 siRNA)。PEG化技术的重要用途之一是基于mRNA 的 PEG化脂质纳米颗粒中的新冠疫苗。Comiranty®(新冠疫苗,辉瑞/BioNTech 的mRNA疫苗)于 2021 年 8月获得 FDA 的完全批准。新冠大流行极大地重振了脂质纳米颗粒的研究,其中基于脂质的纳米颗粒可能催生出下一代新冠疫苗、新的基于 mRNA 的疫苗和基因编辑疗法,如CRISPR-Cas9。PEG化也已用于修饰小分子。Movantik ®于 2014 年获得批准,是一种PEG化α-纳洛醇衍生物 (naloxegol),可减少跨血脑屏障 (BBB) 的转运,以防止中枢神经系统的副作用。大多数药物的递送需要克服 BBB的阻碍,但阻止跨BBB 的运输在这里找到了成功的应用。
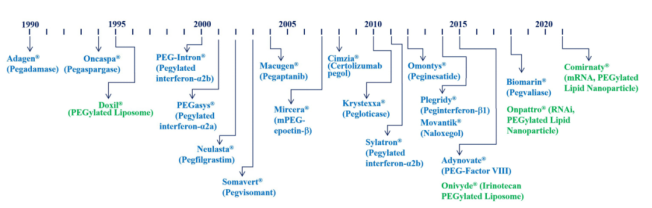
图一:过去二十年PEG化药物的发展。PEG化在脂质体和脂质纳米颗粒制剂的开发中也很关键。
3. 纳米制剂
2000 年,美国政府推出了一项名为国家纳米技术计划(NNI) 的新计划。其在药物发现和递送领域的应用被称为纳米医学。从一开始,纳米医学领域就几乎完全专注于肿瘤靶向药物递送。尽管如此,结果仍低于预期,批准的新抗癌制剂数量很少。 Mylotarg®、Doxil®和Abraxane®(2005 年批准的白蛋白-紫杉醇复合物)已成为纳米医学的代表。Doxil® 和Abraxane® 的批准主要基于减少的副作用,而不是提升治疗效果。然而,该结果并不完全基于流行的“增强渗透性和滞留性”效应,即俗称的 EPR 效应,纳米药物应该具有用于肿瘤靶向药物递送,理论上会产生更有效的产品,同时减少副作用。虽然纳米药物的肿瘤靶向尚未实现,但对各种形式的纳米制剂的研究已经产生了一些重要的附带成果。首先,由于“纳米尺寸”,纳米制剂最终会增加难溶性药物的水溶性。纳米药物晶体或纳米晶体可以足够快地增加难溶性药物的溶解速度。因此,总体结果似乎是增加了水溶性。 FDA 批准的第一个纳米晶体制剂是2000 年的 Rapamune®。纳米医学研究的另一个重要改进是操纵脂质分子结构以更有效地从胞内体中逃逸。结果之一是 Onpattro® 中用于递送siRNA 的脂质制剂,该制剂于 2018 年获得FDA 批准。 Onpattro 含有一种可离子化的阳离子脂质,该脂质针对RNA 封装和细胞内递送进行了优化,以及含有 PEG 的脂质,可调节纳米颗粒的大小。脂质分子和组装结构是开发基于新冠mRNA 的疫苗的关键。
4. 药物-聚合物复合物和偶联物
复合物是通过非共价键结合在一起的单个分子的分子组装,例如静电和/或疏水相互作用。因此,相关分子可以在环境条件变化时解离。药物复合物通常使用水溶性聚合物制成。InFed 是一种含低分子量(5000–7000 Da) 葡聚糖的铁复合物,已被用于纠正缺铁。临床证明,铁与低分子量葡聚糖的复合物比与高分子量葡聚糖(96,000 Da)的复合物更安全。另一种广为人知的药物-聚合物复合物是 Abraxane®,一种用于癌症治疗的 100 毫克紫杉醇纳米粒子,包覆900 毫克人白蛋白。制备药物-聚合物复合物的主要优点是增加难溶性药物的水溶性。药物-聚合物偶联物是一种具有共价结合药物分子的聚合物载体。载体聚合物由于其具有多个官能团的大分子结构,可以携带大量共价结合的药物分子。这个想法很有吸引力,因为除了许多药物分子外,这还允许将靶向部分和显像剂以及其他有用的试剂掺入聚合物主链或功能侧基。从那时起,在临床研究中测试了许多药物-聚合物偶联物,但结果令人失望。添加靶向部分,例如配体或抗体,不会增加靶向特性,因为分布主要受血液循环控制。配体-受体和抗原-抗体相互作用仅在它们成功到达目标位点后才会发生。这里,药物-聚合物偶联物不包括PEG化药物,因为用于PEG化的 PEG 链不具有所提出的药物-聚合物偶联物的聚合物载体的功能。单克隆抗体本身在药物开发中发挥了至关重要的作用。随后,将抗体与药物偶联(Ab-药物偶联物,或ADC)。 2009 年批准用于临床的第一个抗体药物偶联物是Mylotarg® (gemtuzumab ozogamicin)。在 Mylotarg 中,N-乙酰基-γ-加利车霉素分子与 CD33 导向的单克隆抗体共价连接。与CD33 抗原结合导致加利车霉素部分的内化和水解释放,导致 DNA 损伤和细胞死亡。到2020 年,FDA 还批准了另外8 种抗体-药物偶联物。
5. 从纳米制剂的发展,我们学到了什么?
尽管纳米医学领域在开发肿瘤靶向给药系统方面取得的进展缓慢,但在此期间开发的技术一直是针对新冠的mRNA 疫苗的超快速开发的来源。从公布SARS-CoV-2基因序列到启动mRNA疫苗临床试验仅用了2个月时间(图二)。截至2021年12月,已有9种疫苗获批全面使用,FDA批准的前两种疫苗辉瑞/BioNTech和Moderna疫苗均使用mRNA。mRNA非常不稳定,因此需要适当的保护。保护之后必须有效地递送到细胞中并从胞内体中逸出,这样才能有效地作为疫苗。结果证明,PEG化脂质纳米颗粒的工作原理与它们设计的一样。无论如何,这都是制剂科学家的一项了不起的成就。功能性mRNA递送脂质纳米颗粒的这种快速发展之所以成为可能,只是因为用于递送基因药物(如siRNA、mRNA 和质粒 DNA)的复杂递送系统在数十年间取得了进展。虽然脂质纳米粒子对于RNA递送效果很好,但还需要进一步的进步,包括“内体逃逸”以到达细胞质。可电离的脂质在内体中存在酸性 pH值时形成不稳定的非双层结构,最终导致内体逃逸。随着PEG化的进一步研究,可电离脂质的概念被引入以形成可电离脂质纳米颗粒,以有效递送核酸。可电离的脂质在胞内体的酸性环境中形成阳离子,与阴离子脂质相互作用形成倒锥形,导致膜融合、胞内体破裂和捕获的核酸释放到细胞质中。图三总结了长达数十年的纳米医学研究对新冠疫苗的贡献。大多数纳米医学研究都围绕着肿瘤靶向。有两个因素对于靶向递送至肿瘤至关重要:聚乙二醇化可延长循环时间并提高纳米药物的稳定性,以及有效的胞内体逃逸以在细胞质中释放药物。为了递送不稳定的RNA,开发了由PEG化脂质和可电离的阳离子脂质组成的脂质纳米颗粒,以最大限度地提高递送RNA 的稳定性和胞内体逃逸。脂质纳米颗粒制剂已成功用于开发Onpattro®,这是 FDA 批准用于递送靶向甲状腺素运载蛋白的 siRNA 的首个制剂。具有不同可电离阳离子脂质的脂质纳米颗粒配方经过优化,可用于mRNA 疫苗
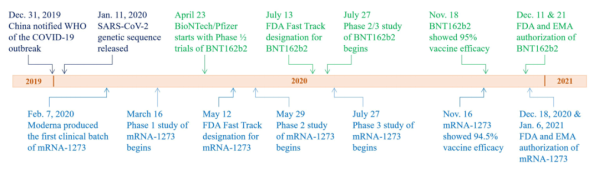
图二:BioNTech/Pfizer (BNT162b2, Green) 和 Moderna (mRNA-1273, Blue) 开发针对新冠的 mRNA 疫苗的时间表。

图三:纳米医学在新冠疫苗快速发展中的贡献精髓。为肿瘤靶向药物递送开发的技术与使用可电离阳离子脂质的 siRNA 递送相结合,导致mRNA新冠疫苗的快速开发。
6. 总结:意料之外的临床结果
自从1984 年确定 HIV 是导致 AIDS 的原因以来,AIDS疫苗的开发一直在进行。自1987年以来,已经完成了十几个HIV疫苗临床试验,但都没有成功。一些试验因安全问题而停止,而其他试验截至2021 年尚未证明对 HIV 的保护作用。可以理解的是,测试疫苗无法提供保护,因为HIV 不是单一类型的病毒,而是由不同类型、群体、亚型和毒株组成。然而,一些临床试验甚至表明疫苗会增加感染HIV 的风险。怀疑风险增加是由于针对研究中使用的重组腺病毒 5 型载体的预先存在的免疫力减弱了疫苗诱导的反应。仅在2021 年,使用一种新的 HIV 免疫原(Alhydrogel®alum)获得了有希望的结果,该免疫原引发广泛的中和抗体与HIV 的保守区域结合。最初,开发了DNA疫苗。它们设计和开发简单,制造快速和直接,具有更好的质量控制,热稳定性好,以冻干形式相对基于mRNA的疫苗运输更简单。但实际问题是细胞摄取率低、需要进入细胞核以及缺乏反应效率。虽然RNA 疫苗是有效的,但与 DNA 相比,它们本质上不稳定,热稳定性差,需要储存低于冰点的温度。2021 年,Moderna 开始了一项第一阶段研究,以评估其HIV-1 mRNA 疫苗的安全性和免疫原性。2021 年似乎是未来mRNA 疫苗的曙光。然而,mRNA 疫苗和RNA 疗法的成功是使用合适的递送系统、脂质纳米颗粒的结果,该系统已经开发了十多年。Pfizer-BioNTech 和 Moderna 脂质纳米颗粒的成分非常相似,其背后的故事可以阐明脂质纳米颗粒制剂的科学如何与商业方面相结合以开发疫苗。自1986 年首次进行 HIV 疫苗临床试验以来,已经过去了三十多年,必须承认HIV 疫苗的开发以及与此相关的任何新制剂的开发是复杂的;应避免追随时代潮流,因为资助机构和科学家都需要长期的努力。目前,mRNA注定会成为未来十年的风潮,但只有时间才能证明当前基于mRNA 的新冠疫苗的惊人成功是否会转化为额外的医学突破。考虑到疫苗和需要稳定疾病治疗之间的开发存在显着差异,预计在未来一两年内只有几种相关的临床产品。尽管新冠大流行带来了令人震惊的后果,但它也以前所未有的速度发挥了我们开发疫苗和新型抗病毒分子的能力。这样的速度可以应用于其他疾病,例如癌症、抗生素抗性细菌和慢性病。
1.慢性疾病
包括十种常见的慢性疾病:高血压、高胆固醇、关节炎、缺血性心脏病(或冠心病)、糖尿病、慢性肾病、心力衰竭、抑郁症、阿尔兹海默症、慢性阻塞性肺疾病。
2.小分子药物和生物制剂
2010年前100名产品中,生物制剂仅占34%,8年后该数字上升为53%,并且应该在未来的几年基本维持在50%。因此,未来的市场大概率为大分子小分子制剂各占一半。目前,大多数生物制剂通过注射进行短期给药。有必要开发可以在数周和数月内都可以维持作用的长效注射剂以提高患者依从性。
3.靶向给药
靶向给药的概念需要澄清。 Paul Ehrlich 提出的魔法子弹(靶向药物)的最初概念是抗毒素或抗体具有选择性靶向细菌而不影响其他生物体。在这里,选择性靶向仅仅意味着“选择性杀死”细菌。抗体仍然分布在全身,但选择性地与目标相互作用。我们服用的大部分药物主要与靶标相互作用,但它们也会与正常细胞相互作用,从而引起副作用。因此,灵丹妙药的概念并不意味着抗体或药物分子到达目标。当前使用纳米药物靶向给药的概念已经演变成与最初的灵丹妙药概念完全不同的东西。如今,如果纳米药物递送比对照(通常是药物溶液)略多的药物来靶向肿瘤,则使用术语“靶向药物递送”。所有的抗癌药物仍然对正常细胞有害,因此,使用“靶向给药”而不影响正常细胞的想法并不适用。此外,将药物或纳米颗粒递送到实体瘤是不够的,因为药物必须通过肿瘤微环境扩散并进入肿瘤细胞才能有效。因此,将药物递送到目标部位不一定与所期待的功效相同。靶向药物递送在基因治疗中是必不可少的。如果功能性基因进入非靶细胞,副作用肯定会随之而来。在基因治疗的早期,甚至是目前的临床基因治疗试验中,一些志愿者由于可以刺激免疫反应的灭活腺病毒载体意外递送到错误的地方而死亡。同样的问题在 2021 年仍然存在:患者在基因治疗试验期间死亡或发展为癌症。虽然基因疗法和细胞疗法将继续提高其安全性和有效性,但它们将面临小分子疗法的激烈竞争,小分子疗法总是更容易生产和管理。
4.克服生理屏障
没有生物屏障,药物递送会容易得多。同时,我们都知道生物屏障对于保护我们免受有害物质的侵害至关重要。生物屏障可分为上皮屏障和内皮屏障。上皮屏障包括粘膜组织(例如,角膜、鼻子、胃肠道和肺)和表皮。内皮屏障,例如血脑屏障,由内皮细胞膜、紧密连接、顶端表面糖萼和基底膜组成。多年来,已经提出了各种方法来克服生理屏障,并且许多方法已显示出药物递送的可能性。然而,更高的药物生物利用度伴随着巨大的代价。一旦生物屏障被破坏,病原体也会一起进入系统。迄今为止,还没有克服生理屏障的安全方法。有必要将小动物实验中克服生物障碍的潜力与临床应用区分开来,以证明安全性和有效性。
4.1口服给药:从小分子到多肽药物
口服给药是最方便、应用最广泛的给药方式。口服给药具有制剂难度,例如低水溶性和低稳定性,以及生理障碍,特别是胃肠道转运时间短、渗透性/吸收低和系统前清除。开发生物药剂学分类系统是为了说明对药物生物利用度、水溶性和渗透性至关重要的两个关键药物特性。为了克服 GI 转运时间短的问题,制剂科学家开发了各种胃滞留制剂,包括漂浮、粘膜粘附、可膨胀、高密度系统、超多孔水凝胶等。尽管如此,胃的生理学差异,包括胃的 pH 值和运动性,会在很大程度上影响吸收和停留时间,从而影响最终的药代动力学特征。尽管如此,真正的胃滞留系统仍有待开发。胃肠道旨在吸收小分子,如碳水化合物、氨基酸和脂溶性分子。所有口服给药的药物都是低分子量药物。通过口服给药来递送肽和蛋白质药物一直是药物递送科学家的梦想,因为其益处是无法估量的。目前已经有了各种方法来克服肽和蛋白质药物吸收不良的问题,但它们都仅处于研发阶段。口服给药的现实是肽和蛋白质药物的生物利用度非常低,无论使用何种给药系统都不实用。当涉及到胰岛素的口服递送时,困难变得无法克服。许多研究表明,胰岛素可以从胃肠道吸收并控制体内葡萄糖水平。这在小鼠中可能是正确的。但即便如此,也需要仔细剖析实验条件的细节。小鼠在注射胰岛素之前保持禁食状态,其数量级比人类使用的胰岛素大几个数量级。微针透皮递送系统也用于递送胰岛素以实现数小时血糖水平的降低。请记住,胰岛素不是一种可以随时以任意浓度范围给药的药物。它必须在准确的时间以准确的量递送才能有效,并且必须对血液中葡萄糖水平的波动做出反应。此外,在降低葡萄糖水平后必须停止释放胰岛素。在正确的时间及时递送准确的剂量对于胰岛素递送至关重要,目前,没有能够满足此类要求的药物递送系统。自我调节的胰岛素递送系统的开发是药物递送的圣杯之一。口服给药一直是最优选的给药途径。然而,需要对口服吸收的关键过程进行进一步的机制理解,例如个体差异、不同性别和年龄之间药物吸收的差异、胃潴留和制剂加工限制(水溶性差的药物和渗透性差的药物)。
4.2 血脑屏障
血脑屏障 (BBB) 一直是治疗中枢神经系统疾病的主要障碍。为了克服血脑屏障,已经开发了各种药物递送系统,例如腺病毒载体、病毒纳米粒子、红细胞膜纳米载体、基于细胞的纳米载体、细胞穿透肽连接纳米载体、细胞外囊泡、可注射水凝胶等。虽然大多数已在小动物模型中显示出有希望的功效,但转化为临床应用仍有很长的路要走。令人鼓舞的是观察到成功通过低密度脂蛋白受体相关蛋白穿过 BBB 的紫杉醇曲伐肽(ANG1005,紫杉醇与 Angiopep-2 的偶联物)的 II 期临床试验。为了证明临床安全性和有效性,必须解决精确剂量、脱靶效应和放大生产问题。缺乏合适的 BBB 模型是阿尔茨海默病、帕金森病、多发性硬化症、癫痫和缺血性中风等疾病制剂开发进展缓慢的因素。缺乏合适的模型不仅限于向大脑递送药物,其他疾病模型,特别是癌症治疗也需要改进。药物还通过鼻内沉积和吸收在嗅觉和呼吸上皮细胞上直接输送到大脑,减少全身扩散并提供更高的生物利用度。然而,这种给药途径需要更多的工作来了解实际的潜在机制。大脑中的药物分布模式是未知的,因此很难使用只有在与特定大脑区域的特定受体结合后才能发挥作用的药物。
4.3 慢性病的长期治疗
慢性病是一种长期的健康问题,可能无法治愈。慢性病的例子有成瘾、阿尔茨海默病、关节炎、哮喘、癌症、慢性阻塞性肺病、克罗恩病、囊性纤维化、糖尿病、抑郁症、癫痫、心脏病、人类免疫缺陷病毒/获得性免疫缺陷综合征(HIV/AIDS) 、高血压、多发性硬化症、帕金森氏病和肺结核。在美国,60% 的成年人患有慢性疾病,40%的成年人患有两种或两种以上。治疗慢性病需要多年的持续治疗。然而,即使在发达国家,对长期治疗的依从性平均为 50%。坚持长期治疗需要的不仅仅是服用处方药。它还包括许多治疗行为,包括就医、配药、适当服药和参加后续预约。在这里,长效制剂无疑有助于提高患者的依从性和便利性,尤其是长效注射制剂,可以连续数周和数月提供每日剂量。自1989年第一个长效注射剂问世以来,只有大约20种药物被制成长效注射剂,持续时间长达6个月。每个制剂的持续时间将超过目前设定的6个月。尽管如此,长期给药取决于每种药物的日剂量、药物稳定性和治疗指数。长效制剂还包括其他制剂,例如,需要手术才能植入体内的装置和另一种需要手术才能移除的装置,除非该制剂设计为可生物降解。如果药物释放多年,手术植入装置可能是必要的,但 Norplant®,一种提供药物5 年的避孕装置,由于无法移除它们可能性而不得不从市场上撤下。因此,使用可生物降解的聚合物优于使用用后必须去除的不可降解的制剂。
5. 原文作者对未来制剂研发提出了以下观点:
i) 回顾药物递送历史发展,认识药物递送系统开发的难度和局限性,避免追求虚无缥缈的热门课题;
ii) 未来是无法预测的。尽管发生了致命的 COVID-19 大流行,我们还是可以找到补救方法并继续我们的生活。通过比较计算机行业取得的进展,可以很容易地认识到行业发展的缓慢程度(图一)。脂质体于 1964 年被发现,同年,基于 1 MB 内存的集成电路的UNIVAC 1108 计算机以 566,460 美元的价格上市。快进到2021 年,计算机内存增加了 30,000 倍,价格降低了200 倍,尺寸同样更小。另一方面,将脂质体转化为聚乙二醇化脂质体 Doxil® 用了30 多年,而开发用于 siRNA 和mRNA 递送的聚乙二醇化脂质纳米颗粒则用了 50 多年。由于临床研究需要时间来证明安全性和有效性,因此新的药物递送制剂的引入必然缓慢且昂贵。新给药系统开发的缓慢主要基于上述安全性和有效性研究,与技术改进呈线性关系。加速制剂开发的一种方法应专注于临床应用而不是微小的技术改进。
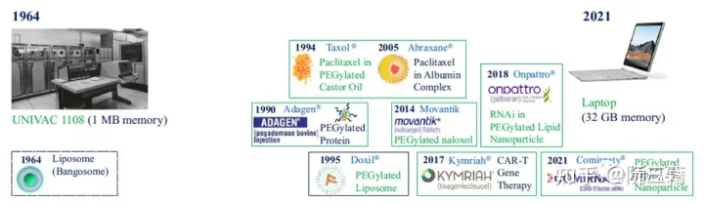
图一:1964年至2021年计算机和脂质体给药系统的演变比较
iii) 最终目标
药物递送研究的最终目标是开发能够以预先确定的释放动力学和持续时间将药物递送到目标部位的制剂。基础研究是必不可少的,但并非所有基础研究成果都适用于患者使用的产品。展示特定药物递送技术的潜力与开发临床产品之间存在根本差异。如果不考虑扩大生产,对青霉素抗菌活性的鉴定就不足以使我们免于感染。这就是为什么除了亚历山大·弗莱明爵士之外,诺贝尔生理学或医学奖被联合授予 Ernst B. Chain 和Howard W. Florey 爵士。用于寡核苷酸递送,尤其是 mRNA 递送的脂质纳米颗粒的研究预计将在一段时间内激增。如果基础研究不能及时转化为临床产品,基础研究的升值势必会很慢,导致公众失去打持久战的耐心。基础研究的性质不同于将产品推向市场的性质。前者侧重于寻找新信息,而后者主要侧重于解决实际问题,这些问题可能看起来并不宏大,但非常重要。新冠疫苗的开发就是一个很好的例子。如果新冠不是在如此短的时间内传播到全世界的生死攸关的疾病,其疫苗的开发可能需要更长的时间。在新冠开始时,针对寨卡病毒和癌症的 mRNA 疫苗已经在人体研究中进行,基于mRNA的疫苗技术的稳健性和多功能性使得新冠疫苗的快速生产成为可能。虽然大多数疾病似乎不像新冠那样紧迫,但每种疾病对病人都具有同样的破坏性。现在是药剂学家将每种疾病作为我们面临的最危险的疾病来处理的时候了。这种思维方式的变化将对研究重点产生重大影响,并使我们从纸上谈兵转向决战沙场。
原文:Park H, Otte A, Park K. Evolution of drug delivery systems: From 1950 to 2020 and beyond. Journal of Controlled Release. 2021 Dec 29.